Scopul și obiectivele lecției: Educativ: să formeze idei despre hidrogen ca element chimic și substanță simplă; extinde cunoștințele despre domeniile de aplicare a hidrogenului. Dezvoltare: dezvoltarea independenței de gândire, dezvoltarea abilităților intelectuale (analiza, compara, stabilește relații cauză-efect, lucrează prin analogie, face ipoteze). Educațional: pentru a forma o viziune științifică, gândire ecologică, pentru a cultiva o cultură a comunicării.

Testul "Da-Nu" 1 - Hidrogenul înseamnă "producător de acid" (nu) 2 - Cel mai frecvent în Univers (da) 3 - Valența sa este - II (nu) 4 - În laborator, se obține prin reacție metale cu acizi. (da) 5 - Primul obținut de J. Priestley. (nu) De 6 - 14,5 ori mai usor decat aerul (da) 7 - Reactioneaza cu metalele si nemetalele. (da) 8 - Substanța simplă hidrogen are formula H. (nu) 9 - Reface metalele din oxizi. (da) 10 - generează multă energie atunci când este ars. (Da)











Ţintă: sistematizarea cunoștințelor elevilor despre hidrogen.
Sarcini:
- Educational: aduceți cunoștințele elevilor despre hidrogen în sistem; să consolideze capacitatea de a aplica cunoștințele dobândite în explicarea unor fapte noi; continuă formarea capacității de a face formule de substanțe, ecuații de reacție bazate pe cunoașterea gradului de oxidare a elementelor.
- Educational: dezvoltarea gândirii elevilor, capacitatea de a analiza, compara, generaliza, observa, memora, lucra în ritmul potrivit, exercita autocontrolul; pentru a forma aptitudini și abilități educaționale generale.
- Educational: a educa calitati personale care sa asigure succesul activitatii executive (disciplina, responsabilitate), activitatea creativa (activitate, entuziasm, observatie, istetire, capacitate de stima de sine).
Metode, tehnici metodologice. Conversație cu elevii, lucru cu hărți instructive și materiale de diapozitive, experiment demonstrativ, metodă de căutare parțială.
Reactivi. Zinc, acid clorhidric, oxid de cupru (II).
Echipamente. Fişa material didactic, tabel elementelor chimice D.I. Mendeleev, cutie, calculator, proiector media; lampă cu spirt, chibrituri, eprubete, suporturi de laborator, cristalizator.
În timpul orelor
I. Motivația. Actualizare de cunoștințe
Profesor: Câte elemente chimice se cunosc?
Student: 110.
Profesor: Câte elemente chimice sunt incluse în compoziția substanțelor care formează celulele tuturor organismelor vii?
Student: peste 70.
Profesor: Baza vieții sunt 6 elemente ale primelor trei perioade (H, C, N, O, P, S), care reprezintă 98% din masa materiei vii. Vom studia una dintre ele astăzi. Dar pe care o învățăm din ghicitorile din cutie.
Ghicitori
- Sunt primul din lume:
În univers, pe planetă,
Mă transform în heliu ușor
luminez soarele pe cer.
- A venit un vizitator din spațiul cosmic
Am găsit adăpost în apă.
Neotrăvitor și inofensiv.
Combinarea cu oxigenul
Vă dau apă de băut.
Student: Hidrogen.
Profesor: Deci, subiectul lecției: Hidrogen. (slide 1. Vezi atașamentul)
II. Învățarea de materiale noi
Profesor: Acum vei pleca într-o călătorie pentru a te familiariza cu un element chimic uimitor - hidrogenul - și cu substanța simplă formată de acesta. Pentru a face acest lucru, veți avea nevoie de un card de ghid. Luați în considerare cu atenție și spuneți unde veți vizita astăzi și ce veți învăța. (diapozitivul 2)
Card de ghid
| Numele statiei | Cartea de reclamații și sugestii | Specialist. note |
| „Descoperirea hidrogenului” | v- asta stiu + - informații noi ! - este interesant |
|
| „Distribuirea hidrogenului” | ||
| „Obținerea de hidrogen” | ||
| „Aplicarea hidrogenului” | ||
| „Alegeți o sarcină” | ||
| "Test" | ||
| "Cuvinte încrucișate" |
Studenți: Ei numesc stațiile, în timp ce formulează scopurile și obiectivele lecției.
Profesor: La fiecare stație există o carte de reclamații și sugestii, unde trebuie să puneți note speciale. ( slide 3)
Stația 1: „Descoperirea hidrogenului” (mesajul studentului)
Profesor: Ascultă cu atenție mesajul și răspunde la întrebarea: „Cine a descoperit hidrogenul și când?”
Descoperirea hidrogenului:
hidrogeniu, fel de apă.
(slide 4)
(formula metanului?),
(slide 5, slide 6 - verificarea sarcinii)
Număr de serie:
Perioadă:
Grup:
Subgrup:
Formula electronică a atomului:
Profesor: De ce a fost plasat hidrogenul în grupa 1 a subgrupului principal și în grupa a 7-a a subgrupului principal al sistemului periodic.
Student: Hidrogenul poate prezenta atât proprietăți oxidante, cât și reducătoare.
Profesor: Care este starea de oxidare a hidrogenului?
Student: +1, -1, 0.
Profesor: Molecula de hidrogen este formată din doi atomi și este formată dintr-o legătură chimică covalentă nepolară.
(slide 7)
Gust:
Culoare:
Miros:
Temperatura de fierbere:
Dizolvare in apa:
(slide 8)
Proprietățile chimice ale hidrogenului:
1) + nemetal:
2H 2 + O 2 \u003d 2H 2 O
H2 + Cl2 \u003d 2HCl
H2 + S = H2S
3H 2 + N 2 \u003d 2NH 3
2) + metal:
H2 + 2Na = 2NaH
H2 + Ca = CaH2
Profesor: Cum crezi că va reacționa hidrogenul cu substanțele complexe? Și cu ce?
Student: Cu oxid bazic.
Profesor: (experiență demonstrativă: CuO + H 2 = H 2 O + Cu)
Student: notează ecuația reacției care determină agentul oxidant și agentul reducător folosind metoda balanței electronice.
(slide 9, slide 10 - verificarea sarcinii)
Obținerea hidrogenului:
1) În laborator:
Zn + HCl \u003d ZnCl 2 + H 2
2) În industrie:
C + H 2 O \u003d CO + H 2
CH 4 + H 2 O \u003d CO + H 2
H 2 O \u003d H 2 + O 2
(slide 11)
III. Test primar de stăpânire a cunoștințelor.
Stația 8: „Alegeți o sarcină”
Sarcini de nivel minim (verificare orală a sarcinilor).
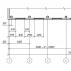
2. În ce figură ( A sau b) este afișată metoda de „transfuzie” a hidrogenului dintr-un vas în altul? Explicați răspunsul.

Sarcini nivel general(verificarea sarcinilor oral și la tablă)
A) cu cărbune
B) cu metan.
Sarcini de nivel avansat (verificarea sarcinilor oral și la tablă)
IV. Consolidarea cunoștințelor
Stația 9: „Test”
1) Cu + HCI;
2) Zn + HCI;
3) Cu + H20;
4) S + NaOH
1) eu;
2) II;
3) III;
4) V
1) fontă;
2) hidrogen;
3) acid clorhidric;
4) aer.
4. Hidrogenul nu reacționează cu:
1) N2;
2) S;
3) O2;
4) HCI
1) călcați cu apă;
2) sodiu cu apă;
3) oxid de calciu cu apă;
1) HCI;
2) 2HCI;
3) 3HCI;
4) 4HCI
8. Hidrogenul reacţionează:
4) numai cu nemetale.
9. Hidrogenul reacţionează cu:
1) H20;
2) SO3;
3) CI2;
4) Au
1) metan cu apă;
2) călcat cu apă;
3) electroliza apei;
4) zinc cu acid clorhidric.
Elevi: după finalizarea sarcinii, faceți schimb de caiete între ei, verificați și acordați note.
Profesor: Răspunsuri corecte:
Stația 10: cuvinte încrucișate (rezervă)

V. Rezumând lecția
Conversație frontală /
VI. Informații despre teme
(slide 13)
Profesor: paragraful 17; ex. Nr. 3,4 la pagina 103.
Literatură
- Gabrielyan O.S.. Chimie. Clasa a 9-a: caiet de lucru pentru manualul lui O.S. Gabrielyan „Chimie. Clasa 9”/ O.S. Gabrielyan, A.V. Yashukova. – Ed. a VI-a, stereotip. – M.: Butarda, 2007.
- Gabrielyan O.S.. Chimie. Clasa a 9-a: manual. pentru învăţământul general Instituţii / O.S.Gabrielyan. - Ed. a XII-a, stereotip. – M.: Butarda, 2007.
- Gorkovenko M.Yu. Chimie. Clasa a 8-a: Dezvoltarea lecției pentru manualele lui O.S. Gabrielyan; L.S. Guzeya, V.V. Sorokin, R.P. Surovtseva; G.E. Rudzitis, F.G. Feldman. – M.: VAKO, 2004.
- Guzey L.S. si etc. Chimie. Clasa a 8-a: studii pentru învățământul general. instituții / L.S. Guzey, V.V. Sorokin, R.P. Surovtseva. - Ed. a 6-a, rebrandata. si suplimentare – M.: Butarda, 2001.
- Examen de stat unificat 2001: Sarcini de testare: Chimie / M.G. Minin, N.S. Mikhailova, V.F. Gridaev și alții; Ministerul Educației al Federației Ruse. - Ed. a II-a. - M .: Educație, 2002.
- Kataeva L.G., Tolkacheva T.K.. Chimie: carduri de sarcini pentru non-organ. Chimie: 8 celule: Carte. pentru profesor. – M.: Iluminismul, 1998.
- Revista științifico-teoretică și metodică „Chimie la școală”, Nr. 10 2002, Nr. 3 2004, Nr. 4 2008.
- Surovtseva R.P.. Chimie. Clasa a VIII-a: Desfășurarea lecției cu material didactic pentru manual de L.S. Guzey, V.V. Sorokin, R.P. Surovtseva „Chimie. 8”/ R.P. Surovtseva, M.I. Vinogradova. - Ed. a II-a, stereotip. – M.: Butarda, 2004.
- Texte de chimie. - 8-9 celule: Metoda educațională. Benefit / R.P.Surovtseva, L.S.Guzey, N.I.Ostanniy, A.O.Tatur. - Ed. a IV-a, stereotip. – M.: Dropia, 2000.
- Ziar educațional și metodic pentru profesori „Chimie” Editura „Pervoe Septembrie”: Nr. 10, 24 2008: Nr. 2 2009.
Înmânează
Card de ghid
| Numele statiei | Cartea de reclamații și sugestii | Specialist. note |
| „Descoperirea hidrogenului” | v- asta stiu + - informații noi - - informații care contrazic cunoștințele mele ? - informațiile necesită clarificări ! - este interesant |
|
| „Distribuirea hidrogenului” | ||
| „Carte de vizită a unui element chimic” | ||
| „Proprietățile fizice ale unei substanțe simple” | ||
| „Proprietăți chimice ale unei substanțe simple” | ||
| „Obținerea de hidrogen” | ||
| „Aplicarea hidrogenului” | ||
| „Alegeți o sarcină” | ||
| "Test" | ||
| "Cuvinte încrucișate" |
Stația 2: „Propagarea hidrogenului”
Timp de parcare 3 min. Citiți textul și răspundeți la întrebarea: De ce hidrogenul este primul, dar al doilea?
Hidrogenul este cel mai abundent din universul nostru. Reprezintă aproximativ 92% din toți atomii (8% sunt atomi de heliu, ponderea tuturor celorlalți combinați este mai mică de 0,1%). Astfel, hidrogenul este componenta principală a stelelor și a gazului interstelar. În condițiile temperaturilor stelare (de exemplu, temperatura suprafeței Soarelui este de 6000 ° C) și spațiului interstelar pătruns de radiația cosmică, acest element există sub formă de atomi individuali.
Fracția de masă a hidrogenului din scoarța terestră este de 1% - acesta este al nouălea element cel mai comun. Cu toate acestea, rolul său în natură este determinat nu de masă, ci de numărul de atomi, a căror proporție între alte elemente este de -17% (locul al doilea după oxigen, a căror proporție de atomi este de -52%). Prin urmare, importanța hidrogenului în procesele chimice care au loc pe Pământ este aproape la fel de mare ca cea a oxigenului.
Spre deosebire de oxigen, care există pe Pământ atât în stare legată, cât și în stare liberă, aproape tot hidrogenul de pe Pământ este sub formă de compuși; doar o cantitate foarte mică de hidrogen sub formă de substanță simplă este prezentă în atmosferă (0,00005% în volum).
Principalul compus al hidrogenului este apa. În plus, o mare cantitate din acesta face parte din numeroși compuși cu carbon (substanțe organice) care formează baza uleiului, gaz natural (formula metanului?), cărbunele etc. Este o componentă indispensabilă a substanțelor care formează organismele vii (-6,5% din masa uscată).
Stația 3: „Carte de vizită pentru elemente chimice”
Timp de parcare 3 min. Lucrând în perechi, determinați poziția elementului în sistemul periodic, întocmiți formula electronică a atomului. Faceți notițe în caiet:
Număr de serie:
Perioadă:
Grup:
Subgrup:
Formula electronică a atomului:
Stația 4: „Proprietățile fizice ale unei substanțe simple”
Timp de parcare 3 min. Lucrați în perechi. Notează în caiet proprietățile fizice ale unei substanțe simple conform desenului de pe diapozitiv:
Gust:
Culoare:
Miros:
Temperatura de fierbere:
Dizolvare in apa:
Stația 5: „Proprietățile chimice ale unei substanțe simple”
Timp de parcare 15 min. Lucrați în perechi. Notează proprietățile chimice ale hidrogenului în caiet. Pentru ecuațiile de reacție subliniate, se determină agentul de oxidare și agentul reducător folosind metoda echilibrului electronic.
Proprietățile chimice ale hidrogenului:
1) + nemetal:
2H 2 + O 2 \u003d 2H 2 O
H2 + Cl2 \u003d 2HCl
H2 + S = H2S
3H 2 + N 2 \u003d 2NH 3
2) + metal:
H2 + 2Na = 2NaH
H2 + Ca = CaH2
Stația 6: „Obținerea hidrogenului”
Timp de parcare 3 min. Lucrați în perechi. Notați producția de hidrogen în caiet. Aranjați coeficienții în ecuațiile de reacție.
Obținerea hidrogenului:
1) În laborator:
Zn + HCl \u003d ZnCl 2 + H 22) În industrie:
C + H 2 O \u003d CO + H 2
CH 4 + H 2 O \u003d CO + H 2
H 2 O \u003d H 2 + O 2
Stația 7: „Aplicarea hidrogenului”
Timp de parcare 1 min. Lucrați în perechi. Notează în caiet utilizarea hidrogenului, folosind materialul manualului fig.46, p.101.
Stația 8: „Alegeți o sarcină”
Timp de parcare 4 min. Lucrează pe cont propriu. Selectați numai acele sarcini
Ce poți face (opțional):
Locuri de muncă la nivel minim
1. Se ridică bule de săpun pline cu hidrogen. Explicați acest fenomen.
2. În ce figură ( A sau b) este afișată metoda de „transfuzie” a hidrogenului dintr-un vas în altul? Explicați răspunsul.
Sarcini de nivel general
Scrieți ecuațiile pentru reacțiile de producere a hidrogenului prin conversia vaporilor de apă:
A) cu cărbune
B) cu metan.
Sarcini de nivel avansat
Scrieți ecuațiile de reacție pentru următoarele tranziții: H 2 SO 4 - H 2 - H 2 O - KOH
Stația 9: „Test”
Timp de parcare 5 min. Lucrează pe cont propriu. Alegeți un răspuns corect:
1. Hidrogenul este un produs al interacțiunii:
1) Cu + HCI;
2) Zn + HCI;
3) Cu + H20;
4) S + NaOH
2. Indicați valența fosforului în compusul cu hidrogen:
1) eu;
2) II;
3) III;
4) V
3. O substanță individuală este:
1) fontă;
2) hidrogen;
3) acid clorhidric;
4) aer.
4. Hidrogenul nu reacționează cu:
1) N2;
2) S;
3) O2;
4) HCI
5. Proprietățile chimice ale hidrogenului sunt utilizate pentru:
1) obtinerea de temperaturi ultra-scazute;
2) umplerea stratostatelor și baloanelor;
3) obţinerea metalelor din oxizii acestora;
4) îndepărtarea căldurii în mașinile electrice.
6. Hidrogenul în laborator se obține prin interacțiune:
1) călcați cu apă;
2) sodiu cu apă;
3) oxid de calciu cu apă;
4) zinc cu acid clorhidric.
7. Formula produsului de reacție și coeficientul din fața acestuia în ecuația de reacție a interacțiunii hidrogenului cu clorul:
1) HCI;
2) 2HCI;
3) 3HCI;
4) 4HCI
8. Hidrogenul reacţionează:
1) numai cu substanțe simple;
2) cu substante simple si complexe;
3) numai cu substanțe complexe;
4) numai cu nemetale.
9. Hidrogenul reacţionează cu:
1) H20;
2) SO3;
3) CI2;
4) Au
10. În industrie, hidrogenul nu a fost obținut și nu se obține prin interacțiune:
1) etan cu apă;
2) călcat cu apă;
3) electroliza apei;
4) zinc cu acid clorhidric.
Stația 10: cuvinte încrucișate
Timp de parcare 3 min. Lucrați în perechi.
Cuvântul cheie este numele stelei cea mai apropiată de Pământ, care este dominată de elementul chimic hidrogen. Fiecare fenomen chimic propus este confirmat de ecuațiile corespunzătoare ale reacțiilor chimice.

- Compuși care se combină cu hidrogenul pentru a forma metale.
- O substanță care se formează atunci când hidrogenul este ars în oxigen.
- Acizi formați din atomi de hidrogen și alt element chimic.
- Un acid care se descompune ușor în monoxid de carbon (IV) și apă.
- Un metal care interacționează direct cu hidrogenul.
- Acid, al cărui nivel de producție poate fi judecat în funcție de putere industria chimicaţări.
Mesaj al elevului
Descoperirea hidrogenului:
Omul de știință englez Henry Cavendish a obținut în 1766 hidrogenul prin acțiunea zincului, staniului sau fierului cu acidul sulfuric sau clorhidric. Alți oameni de știință au obținut și hidrogen înainte de Cavendish, dar nu au încercat să-i studieze proprietățile. Este interesant de observat că hidrogenul a fost confundat cu un fel de aer sau flogiston. Lomonosov a scris în disertația sa „Despre strălucirea metalică”: „Când orice metal de bază, în special fierul, este dizolvat în alcooli acizi, vaporii combustibili scapă din deschiderea balonului, care este un flogiston”.
Majoritatea cercetătorilor, inclusiv Cavendish, au luat hidrogen pentru flogiston și l-au numit „gaz combustibil”. Cavendish a fost primul care a descris în detaliu metodele de obținere, precum și proprietățile fizice și chimice ale hidrogenului. El a descoperit că hidrogenul nu se dizolvă în apă și alcalii; atunci când este amestecat cu aer, se formează un amestec exploziv. Prin urmare, Cavendish a dat numele de „aer combustibil” noului gaz. Deoarece același gaz a fost eliberat sub acțiunea acizilor asupra diferitelor metale, Cavendish a fost convins, în opinia sa, că hidrogenul este flogiston. În 1781, un om de știință englez, observând arderea hidrogenului în aer: H 2 + O 2 \u003d 2H 2 O, a descoperit că Când hidrogenul este ars, acesta se transformă în apă pură. Dar a tras concluzia greșită, crezând că apa, o substanță elementară, adică. simplu. În 1783–1784 A. Lavoisier, împreună cu J. Meunier, au efectuat descompunerea termică a apei și au constatat că aceasta este formată din oxigen și hidrogen.
Datele lui Lavoisier: 85 de părți de oxigen și 15 de părți de hidrogen.
Date moderne: 88,9% oxigen și 11,2% hidrogen.
Denumirea modernă pentru hidrogen a fost dată de fizicianul și chimistul francez A. Guiton de Morvo în 1787. El a sugerat numele latin hidrogeniu, adică „născând apă”. Nume rusesc (sensul este același): fel de apă.
Hidrogenul a fost prima substanță gazoasă simplă cunoscută. Descoperirea sa a fost de mare importanță pentru dezvoltarea chimiei științifice moderne.
Ghicitori
Sunt primul din lume:
În univers, pe planetă,
Mă transform în heliu ușor
luminez soarele pe cer.A venit un vizitator din spațiul cosmic
Am găsit adăpost în apă.Eu, cel mai ușor și incolor gaz,
Neotrăvitor și inofensiv.
Combinarea cu oxigenul
Vă dau apă de băut.